اقتباس:
المشاركة الأصلية كتبت بواسطة koombola
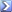
[r= k [A]2 . [B
اذا كان معدل التفاعل الكيميائي بين A,Bيعبر عنه بالقانون الموضح بالأعلى
فماذا يحدث لتركيز B حتي يقل معدل التفاعل الي 75% من معدل حدوثه عند انخفاض تركيز A للنصف
1- يتضاعف
2- يزداد
3- يقل الي النصف
4- يضرب في 4/3 اربعه على ثلاثه
مع ذكر السبب من فضلكم  |
ــــــــــــــــــــــــــــــــــــــــــــــــــ ــــــــــــــــــــــــــــــــــــــــــــــــــ ــــــــــــــــــــــــــــــــــــــــــــــــــ ــــــــــــــــ
دى علاقة رياضية ممكن اوضحهالك و يارب الطرقة تكون سهلة
لوفرضنا ان r فى الحالة الأولى =100 اى ان
100 = k . A2 . B
بعد ذلك ;
r = 75 , ال A يصبح A/2 و بالتعويض فى المعادلة
75 = k.(A/2)2 .b
بقسمة المعادلتين نجدان
b = 3B